EL ÁTOMO
Átomo significa sin división y es el conjunto de corpúsculos subatómicos asociados en números determinados que tienen masa y carga electrica
| Año | Científico | Descubrimientos experimentales | Modelo atómico | ||||||
| 1808 |
|
| |||||||
| 1897 |
|
| |||||||
| 1911 |
|
| |||||||
| 1913 |
|
| |||||||
| |
| |
· REPRESENTACIÓN SIMBOLICA DEL ÁTOMO
Símbolo general:
A=Z+N: NUMERO MASICO
Z=A+N: NUMERO ATOMICO
M: SIMBOLO DEL ELEMENTO
NUMERO MASICO (A):
Es la masa de los protones y neutrones del nucleó, ya que la masa de los electrones (e) es despreciable.
NUMERO ATOMICO (Z):
Es el numero de los protones que existe en el nucleo.
ISOTOPOS, ISOBAROS, ISOTONOS
· ISÓTOPOS:
Son átomos que tienen igual números atómicos y diferente numero másico.
· ISÓBAROS:
Son átomos de igual masa atómica, pero de diferente numero atómico.
· ISÓTONOS:
Son átomos que tienen igual numeros de neutrones.
· NUMEROS CUANTICOS
Describen los valores de las variables dinámicas que se conservan en los sistemas cuánticos que permiten caracterizar los estados estacionarios, es decir los estados propios.
El NUMERO CUANTICO PRINCIPAL (n)
Este número cuántico indica la distancia entre el núcleo y el electrón, medida en niveles energéticos, pero la distancia media en unidades de longitud también crece monótonamente con n. Los valores de este número, que corresponde al número del nivel energético, varían entre 1 e infinito, mas solo se conocen átomos que tengan hasta 7 niveles energéticos en su estado fundamental.
El NÚMERO CUANTICO DEL MOMENTO ANGULAR O AZIMUTAL
(l = 0, 1,2,3,4,5,...,n-1),
Indica la forma de los orbitales y el subnivel de energía en el que se encuentra el electrón. Un orbital de un átomo hidrogenoide tiene l nodos angulares y n-1-l nodos radiales. Si:
l = 0: Suborbital "s" ("forma circular") →s proviene de Sharp (nítido) (*)
l = 1: Suborbital "p" ("forma semicircular achatada") →p proviene de principal (*)
l = 2: Suborbital "d" ("forma lobular, con anillo nodal") →d proviene de difuse (difuso) (*)
l = 3: Suborbital "f" ("lobulares con nodos radiales") →f proviene de fundamental (*)
l = 4: Suborbital "g" (*)
l = 5: Suborbital "h" (*)
(*) Para obtener mayor información sobre los orbitales vea el artículo Orbital.
III) El NUMERO CUANTICO MAGNETICO (m, ml),
Indica la orientación espacial del subnivel de energía, "(m = -l,...,0,...,l)". Para cada valor de l hay 2l+1 valores de m.
IV) El NUMERO CUANTICO DE SPIN (s, ms),
indica el sentido de giro del campo magnético que produce el electrón al girar sobre su eje. Toma valores 1/2 y -1/2.
En resumen, el estado cuántico de un electrón está determinado por sus números cuánticos:
| nombre | símbolo | significado orbital | rango de valores | valor ejemplo |
| número cuántico principal | | shell o capa | | |
| | subshell o subcapa | | para : | |
| | energía shift | | para : | |
| número cuántico proyección de espín | | espín | | para un electrón, sea: |
· PRINCIPIO DE EXCLUSION DE PAULI
En un mismo átomo dos electrones no pueden presentar sus cuatro números cuánticos iguales.
· PRINCIPIO DE LA MULTIPLICIDAD MAXIMA DE HUND
En los orbitales correspondientes a un subnivel. Primero se llenan los electrones con espín positivos y luego los negativos.
· CONFIGURACIÓN ELECTRONICA
17C: 1s2 2s2 2p6 3s2 3p6
· FORMA DE ORBITALES
Por simplicidad, se recogen las formas de la parte angular de los orbitales, obviando los nodos radiales, que siempre tienen forma esférica.
ORBITAL (s)
El orbital s tiene simetría esférica alrededor del núcleo atómico. En la figura siguiente se muestran dos formas alternativas de representar la nube electrónica de un orbital s: en la primera, la probabilidad de encontrar al electrón (representada por la densidad de puntos) disminuye a medida que nos alejamos del centro; en la segunda, se representa el volumen esférico en que el electrón pasa la mayor parte del tiempo.
ORBITAL (p)
La forma geométrica de los orbitales p es la de dos esferas achatadas hacia el punto de contacto (el núcleo atómico) y orientadas según los ejes de coordenadas. En función de los valores que puede tomar el tercer número cuántico ml (-1, 0 y 1) se obtienen los tres orbitales p simétricos respecto a los ejes x, z e y. Análogamente al caso anterior, los orbitales p presentan n-2 nodos radiales en la densidad electrónica, de modo que al incrementarse el valor del número cuántico principal la probabilidad de encontrar el electrón se aleja del núcleo atómico. El orbital "p" representa también la energía que posee un electrón y se incrementa a medida que se aleja entre la distancia del núcleo y el orbital.
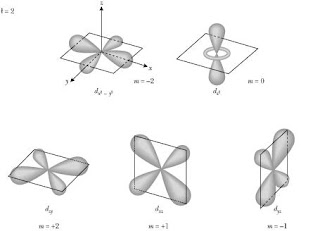
Orbital d
Los orbitales d tienen formas más diversas
Cuatro de ellos tienen forma de 4 lóbulos de signos alternados (dos planos nodales, en diferentes orientaciones del espacio), y el último es un doble lóbulo rodeado por un anillo (un doble cono nodal). Siguiendo la misma tendencia, presentan n-3 nodos radiales.